Le virus du Nil occidental (Orthoflavivirus nilense) est une maladie saisonnière transmise par les moustiques, présente en Saskatchewan ainsi que dans de nombreuses autres provinces canadiennes. Il a été introduit à New York en 1999 et s’est propagé à travers l’Amérique du Nord au cours des années suivantes. Le bureau de l’Ouest et du Nord du Réseau canadien pour la santé de la faune (RCSF), qui offre des services diagnostiques pour la Saskatchewan, les Territoires du Nord-Ouest et le Yukon, a observé une augmentation significative du nombre d’oiseaux sauvages positifs au VNO provenant de la Saskatchewan cette année. Les questions posées par les soumissionnaires ont conduit à la rédaction de cet article.
Faits essentiels:
- Le virus du Nil occidental a été introduit à New York en 1999 et s’est propagé à travers l’Amérique du Nord au cours des années suivantes.
- Le VNO est transmis par les moustiques, principalement ceux du genre Culex.
- Ce virus se maintient dans la nature grâce à un cycle de transmission moustique–oiseau–moustique.
- La transmission aux humains, chevaux, autres mammifères et oiseaux se fait principalement par les piqûres de moustiques infectés.
- Il n’existe aucune preuve de transmission directe ou par simple contact avec les oiseaux.
- Oiseaux : l’infection est souvent fatale, particulièrement chez les corvidés (corneilles, corbeaux, pies, geais) et les oiseaux de proie (aigles, buses, faucons, hiboux) qui sont très sensibles au virus; les survivants peuvent garder des séquelles.
- Chevaux : l’infection entraîne rarement une maladie; lorsqu’elle se manifeste, elle varie d’épisodes de fièvre et de faiblesse, jusqu’à des signes neurologiques graves et la mort; des effets à long terme sont possibles; des vaccins efficaces existent.
- Humains : l’infection est souvent asymptomatique; lorsqu’il y a des signes, ils vont d’une maladie grippale à (rarement) des symptômes neurologiques graves et occasionnellement la mort; des séquelles sont possibles; aucun vaccin n’est disponible.
Situation actuelle en Saskatchewan
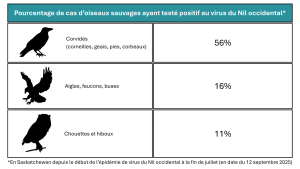
En date du 12 septembre 2025, 83 oiseaux sauvages en Saskatchewan ont été testés positifs pour le VNO, avec 2 autres cas en attente de confirmation. Notre laboratoire a commencé les tests début mai et les premiers cas positifs sont apparus fin juillet. Depuis ces premiers résultats, 56 % des corvidés testés étaient positifs, ainsi que 16 % des oiseaux de proie diurnes et 11 % des hiboux¹. Plus de 300 oiseaux provenant de la Saskatchewan ont été testés jusqu’à présent.
Au 12 septembre 2025, le risque de transmission du VNO est élevé dans l’écozone des Prairies de la Saskatchewan, modéré dans l’écorégion boréale de transition, et minimal plus au nord.
Pour des informations actualisées sur le niveau de risque du VNO et les résultats de surveillance chez les oiseaux, chevaux et humains en Saskatchewan, consultez la page Web (en anglais) du Government of Saskatchewan West Nile Virus Risk Level and Surveillance Results
1Ces résultats ne représentent pas la prévalence de l’infection par le virus du Nil occidental chez les oiseaux sauvages, mais reflètent le pourcentage de morts pouvant probablement être attribués à ce virus.
Transmission et cycle de vie du virus
Le virus du Nil occidental se maintient dans la nature grâce à un cycle entre les moustiques et les oiseaux. Les moustiques s’infectent en se nourrissant de sang d’oiseaux porteurs du virus, puis peuvent transmettre l’infection à d’autres oiseaux. Certains moustiques infectés peuvent également piquer des humains, des chevaux et d’autres mammifères ou oiseaux, leur transmettant ainsi le virus.
Les mammifères et certains oiseaux (notamment les oiseaux de proie et les passereaux non-corvidés) sont considérés comme des hôtes accidentels, car ils ne contribuent pas de manière significative à la transmission du virus — ils développent une charge virale sanguine trop faible pour infecter de nouveaux moustiques. Les corvidés (corneilles, corbeaux, geais et pies) présentent, quant à eux, une forte virémie, ce qui permet à davantage de moustiques de devenir porteurs et de continuer à propager le virus.
Lorsqu’un moustique acquiert le virus, celui-ci doit se répliquer de nouveau et migrer vers les glandes salivaires du moustique afin que ce dernier puisse transmettre la maladie. Ainsi, la probabilité qu’un moustique contracte le virus et transmette la maladie dépend de plusieurs facteurs : l’espèce d’oiseau concernée, la concentration virale dans le sang de l’oiseau, l’espèce de moustique (car toutes ne peuvent pas être infectées et certaines préfèrent se nourrir sur des hôtes différents), ainsi que la capacité du virus à se répliquer à l’intérieur du moustique. On croit que le VNO ne provoque pas de maladie ni de mortalité chez les moustiques eux-mêmes.
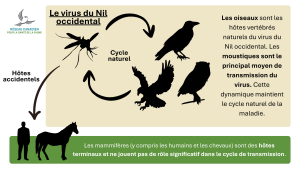
Les mammifères (y compris les humains) sont des hôtes terminaux et ne jouent pas de rôle significatif dans le cycle de transmission. Chez les mammifères, le virus ne peut pas atteindre une concentration suffisante pour être transmis à d’autres moustiques lors de repas sanguins subséquents. Bien que d’autres voies de transmission rares existent (par exemple de la mère à l’enfant ou par contact d’une plaie ouverte avec du sang humain ou aviaire infecté), les moustiques demeurent la principale voie de transmission. Il n’existe aucune preuve que la maladie se propage par un contact direct avec les oiseaux.
Compte tenu de ces facteurs de transmission, que devient le virus en hiver si des flambées peuvent survenir chaque année? Les moustiques sont des insectes à sang froid qui nécessitent des températures chaudes pour accroître et maintenir leur niveau d’activité, leur métabolisme et leur développement. Les moustiques du genre Culex entrent dans une période de développement suspendu lorsque les conditions environnementales sont défavorables (p. ex. températures froides) et redeviennent actifs lorsque les conditions s’améliorent (p. ex. températures plus chaudes). Les femelles moustiques peuvent également transmettre le virus à leur descendance (transmission verticale). Comme le VNO n’affecte pas la santé des moustiques infectés, le virus peut survivre durant l’hiver et le printemps jusqu’à ce que les températures soient suffisamment élevées pour permettre la reprise de l’activité des moustiques et de la transmission virale, entraînant ainsi des cas de VNO au début de l’été, avec un pic à la fin de l’été et à l’automne. La transmission cesse lorsque l’activité des moustiques s’arrête, soit en raison de la baisse des températures, soit après un gel.
Signes et symptômes
La période entre l’infection et l’apparition des signes (période d’incubation) est similaire chez les oiseaux, les chevaux et les humains – environ 2 jours à 2 semaines.
Oiseaux
Chez certains oiseaux, le VNO peut provoquer peu de signes, comme chez les merles d’Amérique, mais chez d’autres il peut affecter un large éventail de tissus et de systèmes, y compris le système nerveux central (voir la Figure 3 pour une liste non exhaustive de signes cliniques). Les oiseaux qui survivent au VNO peuvent présenter des séquelles, comme des lésions au cerveau, au cœur et au système immunitaire, qui peuvent avoir des impacts majeurs sur leur survie. Les corvidés, en particulier les juvéniles, sont très sensibles au virus et la plupart meurent dans les trois semaines suivant l’infection.
L’infection par le virus du Nil occidental chez les oiseaux doit être confirmée par des tests de laboratoire, car plusieurs autres maladies peuvent provoquer des signes cliniques similaires, notamment l’influenza aviaire, le choléra aviaire et l’intoxication au plomb.
Chevaux
La maladie clinique chez les chevaux est peu fréquente et généralement bénigne, mais elle peut évoluer vers une atteinte neurologique grave pouvant entraîner la mort (voir la Figure 3 pour une liste non exhaustive de signes cliniques).
De nombreux chevaux se rétablissent complètement après l’infection par le virus, bien que certains puissent présenter des séquelles, notamment des anomalies de la démarche et du comportement. Environ un tiers des chevaux présentant des signes cliniques meurent ou doivent être euthanasiés en raison de complications. Les individus plus à risque d’infections fatales incluent les poulains (âgés d’un an ou moins), les chevaux âgés (15 ans ou plus), ceux qui présentent un décubitus et/ou des signes cliniques graves (p. ex. convulsions, coma), ainsi que les chevaux non vaccinés.
D’autres maladies peuvent provoquer des signes similaires, comme l’herpèsvirus équin et la rage; un test sanguin est nécessaire pour confirmer le diagnostic de VNO chez les chevaux vivants.
Humains
La maladie grave chez l’humain est relativement rare – environ 80 % des personnes infectées ne présentent aucun symptôme. Les personnes qui tombent malades peuvent développer de la fièvre,

des maux de tête et des douleurs musculaires/articulaires, des vomissements, de la diarrhée, une éruption cutanée, de la fatigue et une faiblesse. Le rétablissement complet dépend de la gravité des symptômes et des soins reçus, certaines personnes souffrant de séquelles à long terme comme des douleurs ou une faiblesse musculaire et de la fatigue.
Moins de 1 % des personnes infectées (les personnes immunodéprimées et âgées étant plus susceptibles) développent une infection grave du cerveau et des séquelles plus sérieuses. Cela peut se manifester par de violents maux de tête, une forte fièvre, une raideur de la nuque, une désorientation, un coma, des tremblements, des convulsions ou une paralysie, et peut entraîner la mort.
Si vous suspectez une infection par le virus du Nil occidental, contactez le 811 ou votre agence de soins de santé pour obtenir de l’aide. Le diagnostic est confirmé par des analyses sanguines.
Traitement
Il n’existe pas de traitement spécifique pour l’infection par le VNO, ce qui signifie qu’aucun médicament antiviral ne cible spécifiquement ou n’est efficace contre ce virus. Les soins de soutien pour les signes cliniques constituent le traitement standard pour les humains, les chevaux et les oiseaux, et peuvent inclure des anti-inflammatoires et des perfusions intraveineuses. Les humains et animaux présentant des symptômes graves nécessitent des soins intensifs, bien que l’euthanasie puisse être recommandée pour les oiseaux et les chevaux.
Gestion et prévention

Des vaccins spécifiques contre le VNO destinés aux chevaux existent. Il n’existe pas de vaccins spécifiques pour les oiseaux, mais des vaccins commerciaux pour chevaux ont été utilisés chez des oiseaux de proie en captivité, pouvant offrir une certaine protection; l’exclusion des moustiques des zones où les oiseaux sont gardés reste néanmoins recommandée.
Il n’existe pas de vaccin pour les humains, mais des comportements de protection individuelle (voir Figure 4) permettent de réduire le risque d’infection.
Des mesures de contrôle communautaire sont appliquées dans certaines villes de la Saskatchewan, telles que l’application d’insecticides pour éliminer les moustiques adultes et les larves, bien que l’utilisation de pesticides doive être effectuée avec prudence et que les données sur leur sécurité et leur efficacité pour réduire les cas de VNO soient limitées.
Des stratégies alternatives de lutte contre les moustiques sont mises en œuvre dans d’autres pays. Elles incluent l’utilisation de moustiques génétiquement modifiés, des programmes de stérilisation/contrôle des populations de moustiques, ainsi que la méthode naturelle basée sur Wolbachia, cette dernière étant une méthode célèbre de contrôle des maladies appliquée aux moustiques Aedes aegypti vecteurs de la dengue dans certaines villes et pays chauds, comme le Brésil.
Surveillance
Oiseaux sauvages
Comme la présence et le niveau d’activité du virus fluctuent en fonction de la météo, de la population de moustiques, de la population d’oiseaux et de la capacité du virus à survivre et à circuler entre eux, la mortalité des oiseaux due au VNO peut être (et est) utilisée comme système sentinelle pour suivre la maladie et anticiper les flambées. Des prélèvements oropharyngés et cloacaux initiaux sont réalisés et testés pour le virus par la méthode PCR (réaction en chaîne par polymérase). L’excrétion du virus dans l’environnement par ces voies dépend du stade de la maladie et du type d’oiseau. Les rapaces, par exemple, peuvent excréter peu ou pas de virus et peuvent être négatifs aux prélèvements. Si le VNO reste suspecté comme cause de maladie ou de mort en raison de lésions observées ou d’antécédents de signes cliniques, des tests plus sensibles sont effectués sur les tissus.
Une étude de 2024 a montré qu’un programme de surveillance actif ciblant les corvidés permet de détecter le VNO avant l’apparition de cas humains, à condition que suffisamment d’oiseaux soient testés.
Moustiques
La surveillance des moustiques consiste à piéger les insectes sur des sites représentant l’habitat le plus probable pour les moustiques porteurs du VNO dans une communauté donnée. Les moustiques capturés sont ensuite testés pour le virus. Le niveau de risque chez les moustiques est déterminé à l’aide des taux d’infection (nombre de moustiques infectés/1000) et d’un calcul d’indice de risque (taux d’infection * nombre moyen de Culex spp. par nuit de piège /1000).
Le niveau de risque dans une zone est déterminé en combinant plusieurs informations, y compris le degré d’accumulation de chaleur. Consultez la page du gouvernement de la Saskatchewan : West Nile Virus Risk Level and Surveillance Results.
Implications pour les populations fauniques
Les corbeaux, pies et corneilles constituent des populations d’oiseaux très abondantes et stables. Cependant, à mesure que les flambées deviennent plus graves (nombre de morts) et qu’elles se

propagent (en raison des changements climatiques – l’augmentation des températures entraînera des saisons de transmission plus longues et permettra à la maladie de se répandre dans de nouvelles zones), le risque de conséquences négatives pour les populations fauniques vulnérables augmente.
Les oiseaux de proie constituent l’un de ces groupes vulnérables ; de nombreuses espèces font déjà face à des menaces telles que la perte d’habitat, la pollution, le changement climatique et la chasse illégale, sans prendre en compte les maladies. Le virus du Nil occidental n’est pas la seule maladie menaçant ces populations : la grippe aviaire hautement pathogène (HPAI) est également une cause importante de mortalité aviaire. Une espèce sensible à la fois au VNO et à la HPAI est le faucon pèlerin, qui avait déjà subi un déclin important de sa population au milieu du 20ᵉ siècle, mais qui s’est rétablie après l’interdiction du pesticide organochloré DDT et grâce à un vaste programme d’élevage en captivité et de réintroduction commencé dans les années 1970.
Comment pouvez-vous contribuer à nos efforts de surveillance des maladies
Si vous trouvez un oiseau mort ou un autre animal sauvage, veuillez le signaler au bureau régional du RCSF dans votre région. En Saskatchewan, vous pouvez également contacter le centre régional de l’Ouest et du Nord par téléphone au 306.966.5815 ou par courriel à **@*******sf.ca.
En général, les risques associés à la collecte d’animaux pour déterminer la cause de la mort ou de la maladie sont faibles si des précautions sanitaires raisonnables sont prises. Cependant, certains animaux présentent des risques plus sérieux que d’autres, comme les serpents venimeux, les chauves-souris potentiellement porteuses de la rage, et les oiseaux à risque de grippe aviaire. Votre bureau régional peut fournir des conseils ou une assistance si nécessaire. Le RCSF propose des recommandations sur la manipulation des spécimens sur son site web
Rédigé par : Beatriz Garcia de Sousa & Sabine Kirsch, RCSF Ouest/Nord
Lectures additionnelles
Government of Saskatchewan West Nile virus website: West Nile virus overview, when you are at risk, prevention and personal protection, symptoms and severity, information on animal infections
Site web du gouvernement canadien sur le virus du Nil occidental: Virus du Nil occidental : causes, symptômes, risques, traitement, prévention, surveillance, informations pour les professionnels de la santé
National Collaborating Centre for Infectious Diseases West Nile virus website : overview and history of the disease, thorough information on the transmission cycle and rare transmission pathways, explanation of diagnosis process
Information on Canada’s National West Nile Virus Surveillance System (journal article)
Références
Bergmann, F., Fischer, D., Fischer, L., Maisch, H., Risch, T., Dreyer, S., Sadeghi, B., Geelhaar, D., Grund, L., Merz, S., Groschup, M. H., & Ziegler, U. (2023). Vaccination of zoo birds against West Nile virus—a field study. Vaccines, 11(3), 652. https://doi.org/10.3390/vaccines11030652
Bertram, F.-M., Thompson, P. N., & Venter, M. (2020). Epidemiology and clinical presentation of West Nile virus infection in horses in South Africa, 2016–2017. Pathogens, 10(1), 20. https://doi.org/10.3390/pathogens10010020
Castillo-Olivares, J., & Wood, J. (2004). West Nile virus infection of horses. Veterinary Research, 35(4), 467–483. https://doi.org/10.1051/vetres:2004022
de Souza, W. M., & Weaver, S. C. (2024). Effects of climate change and human activities on vector-borne diseases. Nature Reviews Microbiology, 22(8), 476–491. https://doi.org/10.1038/s41579-024-01026-0
Gould, C. V., Staples, J. E., Guagliardo, S. A., Martin, S. W., Lyons, S., Hills, S. L., Nett, R. J., & Petersen, L. R. (2025). West Nile virus. JAMA, 334(7), 618–628. https://doi.org/10.1001/jama.2025.8737
Jackson, A. (2025, July 23). Brazil Opens the World’s Largest Mosquito Biofactory. World Mosquito Program. https://www.worldmosquitoprogram.org/news-stories/brazil-opens-worlds-largest-mosquito-biofactory
Marra, P. P., Griffing, S., Caffrey, C., Kilpatrick, A. M., McLean, R., Brand, C., Saito, E., Dupuis, A. P., Kramer, L., & Novak, R. (2004). West Nile Virus and Wildlife. BioScience, 54(5), 393–402. https://doi.org/10.1641/0006-3568(2004)054[0393:wnvaw]2.0.co;2
McKenzie, M. (2013, November 30). Resurgence of the Peregrine Falcon . Canadian Geographic. https://canadiangeographic.ca/articles/resurgence-of-the-peregrine-falcon/
Mosquito Control Program. Weyburn, Saskatchewan. (2019, January 2). https://www.weyburn.ca/mosquito-control-program/
Tamba, M., Bonilauri, P., Galletti, G., Casadei, G., Santi, A., Rossi, A., & Calzolari, M. (2024). West Nile virus surveillance using Sentinel Birds: Results of eleven years of testing in Corvids in a region of northern Italy. Frontiers in Veterinary Science, 11. https://doi.org/10.3389/fvets.2024.1407271
West Nile Virus Risk Level and Surveillance Results. Government of Saskatchewan. (n.d.). https://www.saskatchewan.ca/residents/health/diseases-and-conditions/west-nile-virus/west-nile-virus-risk-level-and-surveillance-results
West Nile virus. National Collaborating Centre for Infectious Diseases. (2025, July 10). https://www.nccid.ca/debrief/west-nile-virus/
West Nile virus. World Health Organization. (2017, October 3). https://www.who.int/news-room/fact-sheets/detail/west-nile-virus

